Come tutto è strettamente correlato, ovvero competenze che si intrecciano e collaborano per raggiungere una salute ottimale per le persone, gli animali e l’ambiente. Research4Life ha chiesto a due ricercatori di analizzare il caso di SARS-COV2 alla luce delle conoscenze sui coronaviridae in ambito veterinario. Il loro ottimo contributo ci spiega perchè non ha scientificamente senso temere la possibilità di contagio da parte dei nostri animali da compagnia, su quali studi si basino queste evidenze e quali scorretti comportamenti sono assolutamente da evitare.
L’emergenza sanitaria legata al SARS-COV2 pone l’attenzione su una famiglia di virus ampiamente conosciuta in medicina veterinaria. Le numerose similitudini con le patologie da coronavirus degli animali domestici, in special modo con la peritonite infettiva del gatto, e la grande esperienza nel campo della profilassi vaccinale, possono essere di supporto alla comprensione di un virus emergente di cui si conosce ancora poco.
Marcello Introna, DVM, PhD – Maria Selvaggi, DVM, PhD
La conoscenza delle Coronaviridae è molto profonda in medicina veterinaria, essendo questa famiglia di virus causa di danni ingenti in campo zootecnico, e di patologie di differente gravità negli animali da compagnia. Oltre che sullo studio minuzioso dei vari esponenti di questa famiglia, la ricerca medico veterinaria si è orientata essenzialmente sui vaccini, ma questi hanno dato a oggi risultati abbastanza mediocri, funzionando discretamente nei polli (in virtù del più rudimentale sistema immunitario dei volatili rispetto a quello dei mammiferi), nei bovini e nei suini, ma essendo praticamente inutili nei cani, per i quali sono stati ritirati dal commercio. Situazione particolare riguarda i tentativi di profilassi vaccinale nei gatti nei quali la grave peritonite infettiva (FIP), sostenuta da un alpha-coronavirus, ha annoverato solo fallimenti e addirittura pericoli, tanto da indurre la proscrizione del vaccino stesso, come avremo modo di illustrare più avanti.
Per meglio comprendere a cosa ci stiamo riferendo, oltre all’eventuale ruolo epidemiologico attivo degli animali domestici nell’epidemia da SARS-COV2 che sta sconvolgendo l’intero pianeta, riteniamo opportuno offrire un quadro della situazione il più completo possibile, partendo dalla strategia di replicazione dei virus appartenenti a questa famiglia che presentano delle peculiarità specifiche.
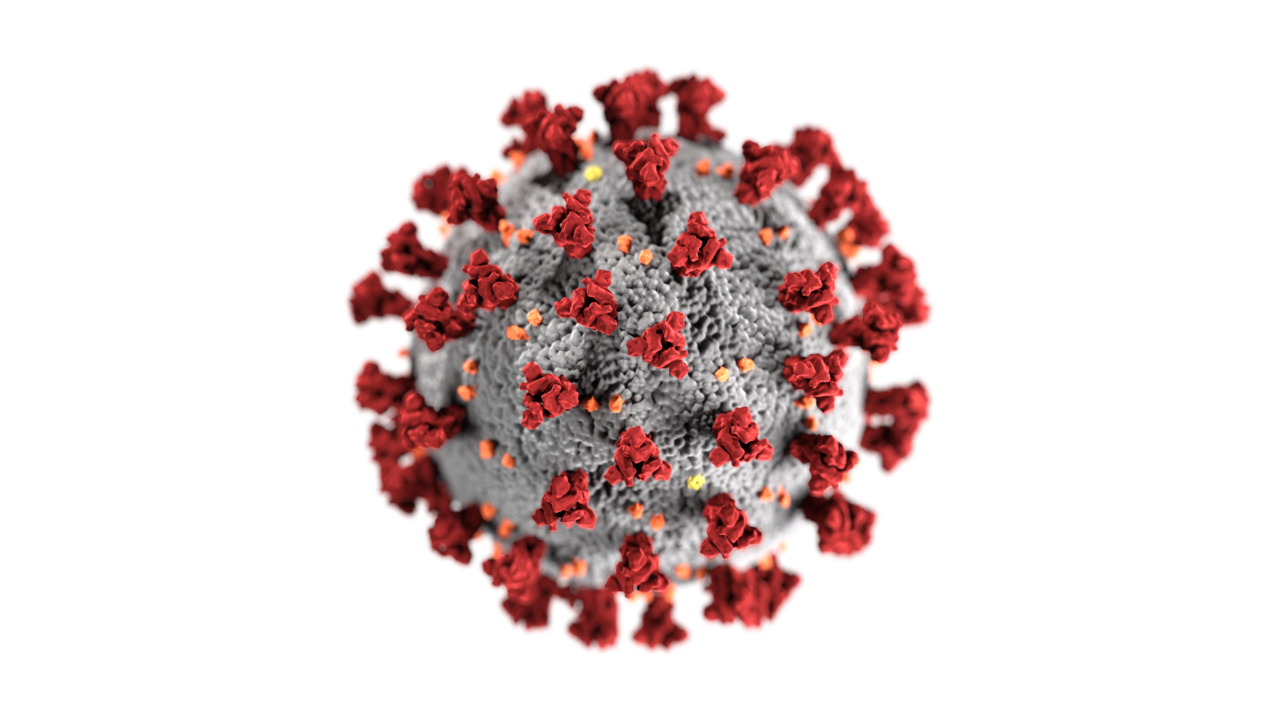
In termini generali alle Coronaviridae appartengono virus di forma sferica grandi 80-160 nm; sono virus a RNA a singolo filamento positivo RNA(+) dotati di envelope (E), di grande plasticità genetica dovuta all’accumulo di mutazioni puntiformi, e di notevole capacità di ricombinazione. Sono virus tendenzialmente specie-specifici e a tropismo tissutale ristretto, sebbene ormai parlare di tropismo ibrido è più opportuno. Risultano particolarmente sensibili all’azione della luce solare (raggi UV), degli antiossidanti, dei solventi lipidici e dei comuni detergenti, e vengono inattivati alla temperatura di 45°C, dopo circa novanta minuti.
In virtù delle loro peculiarità genetiche i coronavirus hanno una spiccata attitudine allo spillover, ovvero al salto di specie, e dunque non dovrebbe stupire, in termini strettamente scientifici, l’avvenuta emersione dell’ennesima infezione conseguente a questo fenomeno nel territorio cinese. Per quanto dimostrare inequivocabilmente il nesso tra spillover, condizioni igieniche dei wet market asiatici, e medicina tradizionale sia impossibile, appare piuttosto chiaro che la promiscuità tra animali domestici e selvatici vivi in questi mercati, le credenze discutibili sulle potenzialità afrodisiache di alcuni prodotti di derivazione animale, la pedissequa invasione e devastazione degli habitat naturali delle specie selvatiche hanno avuto un ruolo attivo, anzi protagonista, nell’emersione e nella diffusione di molte patologie che, più che curare disturbi della sfera sessuale, hanno mietuto vittime in tutto il mondo. Tutte queste condizioni hanno già favorito genesi ed espansione di patologie come la Sars, la Mers, l’influenza aviare e quella suina.
Fatta questa premessa, ritorniamo al peculiare meccanismo di replicazione delle coronaviridae che possiedono il più grande genoma a RNA conosciuto e un envelope dotato di peplomeri a forma di petalo, distanziati tra loro, che conferiscono il tipico aspetto che ricorda la corona solare, da cui il nome della famiglia.
Attualmente sono classificati in quattro generi: alpha-, beta-, gamma-, delta-coronavirus.
Da un punto di vista strutturale, sono dotati di nucleocapside che è formato da una proteina (N) che avvolge il filamento di RNA virale, e da altre proteine strutturali glicosilate inserite sull’envelope da cui sporgono in piccola parte. Queste proteine strutturali si definiscono come proteina matrice (M) la cui funzione è quella ancorare il nucleocapside all’envelope durante l’assemblaggio, e come proteina spike (S) che rappresenta il sito di adsorbimento sul recettore della cellula ospite, permettendo l’ingresso del virus e l’inizio dell’infezione. Gli spike generalmente hanno forma trimerica essendo formati da tre monomeri a struttura secondaria ad α-elica. I tre domini principali degli spike sono:
- Ectodominio: si lega al recettore cellulare
- Dominio transmembrana
- Endodominio con coda terminale
All’interno dell’ectodominio ci sono due subunità funzionali basiche dette S1 e S2. S1 contiene la regione RBD (receptor binding domain) che si lega al recettore della cellula ospite. S2 contiene invece il peptide critico di fusione che permette appunto la fusione tra virus e membrana cellulare ospite. Subito dopo si attivano le proteasi.
La regione RBD rappresenta il sito di adsorbimento per il legame con il recettore della cellula ospite, e in essa sono almeno cinque gli amminoacidi chiave cui si deve l’interazione efficace con lo stesso.
Alcuni appartenenti alla famiglia delle Coronaviridae possiedono anche una proteina nota come emoagglutinina (He) che ha funzione sovrapponibile a quella degli spike, permettendo il legame con recettori specifici dei globuli rossi. Questa proteina, quando presente, condiziona anche l’eluizione del virus dalla membrana degli eritrociti agglutinati.
In estrema sintesi, si può affermare che al legame del virus con il recettore della cellula ospite segue la fusione dell’envelope che consente la liberazione nel citoplasma cellulare dell’RNA virale.
L’RNA si lega ai ribosomi cellulari che provvedono alla sua traduzione la quale comporta la produzione di un enzima, la RNA polimerasi RNA-dipendente (RdRp) grazie alla quale si ha un’ulteriore sintesi di un filamento di RNA(-) che funge da stampo per l’ulteriore sintesi di 6 o 7 mRNA, in funzione della presenza o dell’assenza dell’emoagglutinina, tutti sovrapposti in maniera scalare in modo da avere in comune l’estremità 3’ (nested RNA). Grazie alla polimerasi si ottengono nuovi filamenti di RNA virale, oltre che nuove proteine strutturali e non strutturali.
L’assemblaggio finale dei nuovi virioni avviene al livello del reticolo endoplasmatico rugoso e dell’apparato del Golgi, dove le proteine subiscono un processo di glicosilazione; queste proteine vengono inserite sulla membrana delle vescicole del reticolo endoplasmatico dove, inoltre, il nucleocapside prende contatto con la proteina M.
Il trasporto dei virioni completi neoprodotti avviene grazie alle vescicole del Golgi che si fondono con la membrana cellulare dell’ospite, permettendo l’esocitosi del virus. Nei ceppi di coronavirus più citopatogeni non si assiste all’esocitosi, ma alla lisi della cellula ospite.
È interessante, a tale proposito, il comportamento in vitro delle Coronaviridae; in alcuni casi si ingenera infezione attiva con effetto citopatico, in altri infezione persistente senza segni di sofferenza cellulare e produzione di bassi titoli di virus. Questo dipenderebbe dallo stipite virale e dal tipo di substrato cellulare utilizzato.
Il prototipo della famiglia Coronaviridae è identificato nel virus della bronchite infettiva aviare (IBV) che, così come il virus della gastroenterite trasmissibile del suino (TGEV) o quello della enterite del vitello (BCV), determinano ingenti danni economici per gli allevamenti, soprattutto in termini di calo delle produzioni zootecniche. Generalmente queste patologie assumono carattere epidemico nel momento in cui i virus penetrano in territori indenni, determinando elevata morbilità e mortalità che scemano in occasione di successive infezioni, fino all’insorgenza dello stato endemico e di una quasi totale assenza di sintomi. In altri termini si può affermare che al primo passaggio di un coronavirus in un allevamento con animali in stato di piena recettività, la morbilità e la mortalità sono altissime, e le micelle tracheobronchiali infettanti possono essere veicolate anche a cinquecento metri di distanza, determinando l’insorgenza immediata del carattere epidemico.
Se considerassimo la Terra come un immenso allevamento e la specie umana come l’animale in pieno stato di recettività otterremo un quadro abbastanza sovrapponibile a quello generato dal virus SARS-COV2 che, fortunatamente, non è un virus ad alta patogenicità. Se si fosse diffusa così la MERS, altra patologia sostenuta da coronavirus il cui agente eziologico è presumibilmente passato dal pipistrello all’uomo tramite dromedario, probabilmente assisteremmo adesso ad uno scenario apocalittico, avendo la MERS una mortalità del 35% (quella del SARS-COV2 pare compresa tra lo 0,8 e il 2%).
È importante sottolineare come molti coronavirus siano immunologicamente correlati tra loro, tanto da lasciar presuppore che siano in realtà varianti di uno stesso virus originario. Non a caso il virus della TGEV è correlato con il CCV, coronavirus del cane, e con l’agente eziologico della peritonite infettiva del gatto (FIP). Il siero ottenuto dai suini affetti da TGEV è immunologicamente attivo nei confronti del coronavirus del cane e viceversa, mentre il siero di gatti affetti da FIP è protettivo nei confronti del CCV e non viceversa. Inoltre gatti infettati con il virus della TGEV non sviluppano anticorpi nei confronti della FIP.
Le coronaviridae riconoscono differenti recettori target, e l’ormai tristemente noto SARS-COV2, così come il virus della peritonite infettiva del gatto (FIPV) si lega ai recettori ACE2 (angiotensin-converting-enzyme 2) che hanno una notevole omologia nelle sequenze aminoacidiche nelle differenti specie (uomo, gibbone, scimmia verde, macaco, orango, scimpanzè, cane, gatto, bovino, capra, pecora, suino, cavallo, furetto, civetta delle palme e pipistrello con naso a ferro di cavallo). Sebbene in questi mammiferi esistano sostituzioni aminoacidiche nei residui critici degli ACE2, non si esclude che questo meccanismo possa essere compensato da una interazione efficace del SARS-COV2 con altre regioni del recettore stesso, presente a livello dei polmoni, cuore, testicolo, fegato, rene, intestino e sistema nervoso centrale.
Nel topo e nel ratto i recettori ACE2 sembrano essere poco efficaci nello stabilire una buona interazione con il SARS-COV2, non a caso gli animali attualmente utilizzati in laboratorio per la sperimentazione di un vaccino, sono topi e ratti transgenici capaci di esprimere recettori ACE2 identici a quelli umani.
Per meglio chiarire l’eventuale ruolo epidemiologico degli animali domestici e non, è estremamente utile analizzare i risultati di una recentissima sperimentazione condotta da ricercatori cinesi.
In questo studio si è valutata, a seguito di infezione sperimentale con il SARS-COV2, la portata e l’effettiva esistenza di sieroconversione in cani, gatti, furetti, maiali galline e anatre.
Furetti: infettati sperimentalmente per via oronasale con 105 ufp.
Dopo quattro giorni dall’infezione sperimentale si è quantificato il virus su cellule Vero. Questo è stato rinvenuto esclusivamente nelle cellule degli epiteli dei turbinati, del palato molle e delle tonsille.
Si è rilevata inoltre una grave vasculite, perivasculite linfoplasmacitica, aumento numerico degli pneumociti di tipo 2, dei macrofagi, neutrofili, del volume de setti e dei lumi alveolari e una modesta peribronchite, ma quest’ultima solo nella minoranza dei soggetti. In tutti, però, sono stati rinvenuti anticorpi specifici per il SARS-COV2 (rilevati attraverso tecniche elisa e di sieroneutralizzazione).
Si è dedotto che il SARS-COV2 replica nelle vie respiratorie alte dei furetti, pur senza determinare infezione grave.
Gatti: infettati come i furetti e con la stessa dose di virus.
Alcuni soggetti sono stati sacrificati a tre giorni dall’inoculazione, altri a sei, altri ancora a dodici. Si tratta di animali giovani, di età compresa tra i settanta e i cento giorni.
In soggetti sacrificati a tre giorni si è rilevata presenza del virus negli epiteli di palato molle, tonsille, trachea, polmoni e piccolo intestino.
In soggetti sacrificati a sei giorni, invece, negli epiteli dei turbinati, palato molle, tonsille, trachea e piccolo intestino, ma non più nell’epitelio polmonare.
In soggetti sacrificati a dodici giorni il virus è stato rilevato negli epiteli di tonsille, turbinati, palato molle e trachea.
I gatti infettati sperimentalmente sono stati posti a stretto contatto con soggetti sani che sono risultati poi positivi al SARS-COV2, dimostrando la possibilità di trasmissibilità aerea, sebbene il virus non sia stato poi ritrovato nei tessuti degli animali infettati naturalmente.
In tutti i soggetti utilizzati è avvenuta sieroconversione e produzione di anticorpi specifici.
Si è dedotto che il SARS-COV2 può replicare agevolmente in gatti subadulti, determinando infezioni blande che risolvono spontaneamente e senza alcuna terapia, oltre che lesioni dell’epitelio tracheale, nasale e polmonare. Da tenere presente che gli ACE2 del gatto differiscono da quelli del furetto per soli due amminoacidi.
Cani: medesima procedura di infezione. In particolare sono stati usati dei cuccioli di beagle e tre di questi, infettati sperimentalmente, sono stati posti a contatto con due sani. Si è proceduto all’effettuazione di tamponi rettali e orofaringei dei cani infettati sperimentalmente, e si è rinvenuta presenza di virus nel tampone rettale dopo due giorni dall’inoculazione in tutti e tre gli animali, mentre, a distanza di sei giorni, solo in uno di loro. I cani sani, esposti al contatto con quelli infettati sperimentalmente, non hanno mostrato alcuna infezione e/o reazione, mentre si è accertata sieroconversione, attraverso un saggio elisa, esclusivamente in animali esposti a infezione sperimentale.
Suini, polli e anatre: stessa metodica di infezione. Queste specie non hanno mostrato alcuna suscettibilità al SARS-COV2.
Proprio a proposito di gatti e cani, soprattutto dopo aver evidenziato i risultati di questa sperimentazione, riteniamo grottesco ipotizzare un loro ruolo epidemiologico attivo nella pandemia da SARS-COV2. Con oltre tre milioni di positivi nel mondo, sostenere una funzione da untori per cani e gatti (con cinque casi accertati, nei quali non si è riscontrata alcuna sintomatologia, e in un solo gatto sintomi gastroenterici blandi risoltisi spontaneamente in meno di una settimana) non ha alcuna valenza scientifica, e nemmeno etica, e ha solo determinato un’impennata degli abbandoni DI ANIMALI DOMESTICI. Casomai sono i cani e i gatti che devono temere il contatto con persone positive, non a caso gli unici e infinitesimi casi accertati riguardavano animali i cui proprietari erano positivi e in quarantena. Si può facilmente immaginare che genere di carica virale ambientale e dunque pressione ci fosse in quelle abitazioni, tenendo presente che, fortunatamente, esistono le dosi minime infettanti.
Altra deduzione che si può trarre da questo studio, come dall’esperienza veterinaria in generale, è che la trasmissibilità aerea è una possibilità oggettiva, e che il cincischiare delle autorità sanitarie circa l’utilità delle mascherine per la popolazione è stato probabilmente solo un modo per cercare di coprirne la mancanza, nonché l’impreparazione del nostro sistema sanitario nazionale. Negli allevamenti suini, la trasmissibilità aerea delle micelle tracheo-bronchiali può arrivare, lo ripetiamo, fino a cinquecento metri di distanza in condizioni di particolare favore. Dai risultati emersi dalla sperimentazione cinese, appare estremamente precipitoso proporre i gatti come eventuali animali su cui tentare una sperimentazione vaccinale per il SARS-COV2, perché sarebbero più idonei i furetti, probabilmente per quella differenza di due aminoacidi nel recettore ACE2. Certamente non sono i salotti buoni della prima serata della tv nazionale i luoghi deputati a formulare congetture di questo tipo, e di tali argomenti si dovrebbe discutere esclusivamente negli istituti di ricerca.
Quello che a noi pare eccesso di protagonismo da parte di alcuni esperti sta facendo moltissimi, ulteriori danni: abbandoni su abbandoni.
Inoltre diffondere amenità circa la necessità di disinfettare le zampe degli animali da compagnia per la sicurezza dei proprietari, nominando sostanze estremamente tossiche e irritanti come l’ipoclorito di sodio (varechina) ha determinato la morte di molti cani e gatti per mano dei loro stessi proprietari, ed è particolarmente suggestivo che la causa di questa idiozia siano stati proprio alcuni veterinari animati, forse, da altrettanto eccesso di protagonismo. Ci sono maniere più opportune ed efficaci per discutere, e sedi più “sicure” per parlare di farmaci, protocolli vaccinali e presunte sperimentazioni animali, e diffondere il nome di medicinali è stupido, perché la clorochina, l’ivermectina e l’eparina, sono molto pericolose se usate da persone non esperte, così come gli anticorpi monoclonali che servono principalmente a chi soffre di patologie autoimmuni e ora potrebbe avere difficoltà a reperirli.
Relativamente al ruolo epidemiologico passivo degli animali, studi recenti hanno dimostrato che il SARS-COV2 potrebbe essere passato all’uomo direttamente dal pipistrello, o tramite il pangolino, o aver usato il cane come ospite intermedio. Questa suggestione prende corpo se si pensa al genoma di questo virus. Il SARS-COV2 possiede una frequenza di dinucleosidi guanina/citosina (GC) molto più bassa rispetto agli altri beta-coronavirus, similmente a quella di alcuni ceppi del coronavirus del cane (alfa-coronavirus), e in particolare del ceppo CCoV pantropico e ipervirulento, isolato per la prima volta nel 2005 presso la facoltà di Medicina Veterinaria dell’Università degli Studi di Bari. La presenza di un numero ridotto di dinucleosidi GC nel genoma sarebbe un marker di virulenza, in quanto si tratta di un segnale che attiva una proteina antivirale contenente zinco, definita proteina zap (Zinc finger Antiviral Protein).Più basso è il numero di dinucleosidi GC posseduto dal virus, maggiore sarà la sua resistenza all’azione della proteina zap. Altra ipotesi valutabile riguarda la possibilità che l’ospite intermedio del SARS-COV2, ammesso che esista, possa essere il cane-procione (raccoon-dog) il cui allevamento è diffusissimo in Cina e nel quale il coronavirus pantropico ipervirulento CCoV è stato isolato. Lo stesso virus ha inoltre scambiato delle sequenze genomiche con il coronavirus della gastroenterite suina, facendo emergere un nuovo ceppo definito TGEV-like in grado di colpire i canidi.
Un altro studio ha ipotizzato la maggiore resistenza al SARS-COV2 da parte di persone che sono a stretto contatto con i cani e con i bovini proprio in virtù della crossreattività evidenziata nel caso della TGE suina, della CCV dei cani e della FIP dei gatti. I coronavirus sono tutti strettamente imparentati tra di loro, dunque è possibile che il contatto diretto e continuato con i cani e i bovini possa aver concesso una sorta di immunità crociata alle persone in questione, così come è altrettanto verosimile ipotizzare che la presenza di anticorpi specifici contro i coronavirus di cane e bovino possa al contrario ingenerare un meccanismo noto come potenziamento anticorpo-dipendente di cui parleremo in seguito.
È altresì interessante soffermarsi su un ulteriore aspetto che riguarda i gatti e la loro peritonite infettiva sostenuta da un alfa-coronavirus, perché questa è una patologia che richiama per molti versi il quadro patogenetico e anatomopatologico dell’infezione da SARS-COV2 che colpisce la specie umana.
La FIP è una malattia polimorfa e lo stesso virus può infettare anche felidi selvatici, oltre al già citato suino. La modalità di trasmissione prevede l’ingestione o l’inalazione di particelle virali a seguito di stretto e continuo contatto con animali infetti. È possibile anche la trasmissione per tramite di fomiti infetti, o dell’uomo come vettore passivo.
A seguito di infezione oronasale il virus replica negli enterociti, dove rimane confinato se l’infezione è sostenuta dal biotipo a bassa virulenza FECV (precursore del biotipo virulento FIPV) e in questo caso è possibile osservare enteriti non gravi in soggetti di età compresa tra uno e tre mesi, o decorso totalmente asintomatico negli adulti. Il biotipo FECV a bassa virulenza, in assenza di fattori predisponenti (denutrizione, comorbilità, stress, predisposizione genetica), viene contenuto dalla riposta immunitaria dell’ospite, cosa che non accade con i ceppi a virulenza esaltata.
Nel 5-10% dei casi, infatti, può generarsi, dopo un lungo periodo di infezione enterica, uno switch genetico per il quale da biotipo poco virulento FECV si ha una mutazione in biotipo FIPV a virulenza esaltata. Lo switch è dovuto ad una specifica mutazione nel gene che codifica per la proteina spike e avviene nell’organismo ospite, sebbene non si conosca la motivazione biologica alla base della sua attivazione. Avvenuto lo switch, alla replicazione nell’epitelio intestinale segue la diffusione virale per via linfoematogena all’interno dei monociti, e da qui la colonizzazione di diversi organi e tessuti, con particolare tropismo nei confronti dell’endotelio delle venule e dei vasi venosi di piccolo calibro. A questo livello si realizza una deposizione di monociti infetti e di immunocomplessi responsabili di una intensa ed estesa vasculite complemento-mediata. A questo segue un accumulo di siero molto ricco di fibrina negli spazi intercellulari e versamento toracico e peritoneale.
La malattia, fortunatamente sporadica, insorge con una sintomatologia aspecifica: febbre intermittente, astenia, perdita di peso e appetito, rinite e congiuntivite occasionali. Evolve quindi in due possibili forme.
- Forma essudativa: ingente versamento pleurico e peritoneale di essudato ricchissimo di fibrina, con conseguente aumento del volume addominale e difficoltà respiratoria. L’esito è infausto in 5-7 settimane, che si riducono nel caso gli animali siano giovani.
- Forma granulomatosa: Assenza o presenza minima di essudati, polmonite granulomatosa, linfoadenopatia meseraica, lesioni nodulari in sede renale, polmonare e di altri organi. Sono descritte inoltre lesioni oculari (uveite anteriore bilaterale, corioretinite granulomatosa) e segni neurologici (tremore, nistagmo, atassia locomotoria, anisocoria). Anche in questo caso il decorso della malattia è piuttosto lungo e l’esito generalmente infausto.
Colpisce la recente acquisizione in merito all’esperienza in campo pediatrico secondo cui il SARS-COV2 si renderebbe responsabile in alcuni bambini dell’insorgenza di sintomi gravissimi legati alla malattia di Kawasaki che induce vasculite, perivasculite diffusa e aneurismi con imponente reazione autoimmune.
Nonostante i notevoli sforzi, non è stato ancora sviluppato nessun vaccino funzionante nei confronti del biotipo FIPV. Molti vaccini sperimentali innescano infatti un meccanismo noto come potenziamento anticorpo-dipendente, responsabile di una patologia più grave negli animali immunizzati, rispetto ai non vaccinati. Questo meccanismo è scatenato dall’ingresso del virus anticorpo-mediato nei macrofagi, e potrebbe rappresentare un ostacolo allo sviluppo di vaccini specifici anche nei confronti dell’emergente SARS-COV2. Similmente a quanto accade nei gatti, negli umani affetti da forme gravi di COVID-19, si osserva spesso una sindrome da tempesta citochinica che richiede un poderoso trattamento antinfiammatorio per ridurre il numero dei decessi. Questa tempesta citochinica, che causa parallelamente immunosoppressione, è caratterizzata dall’aumento delle interleuchine 2,6 e 7, del fattore stimolante i granulociti, della proteina 10 indotta dall’interferone gamma, della proteina 1 chemoattrattiva dei monociti, dalla proteina infiammatoria 1α dei macrofagi e dal Tumor necrosis factor-alfa.
Per le stesse ragioni sono falliti i tentativi di allestire un preparato vaccinale per la MERS, perché anche in questo caso gli anticorpi legano gli spike mediandone l’ingresso nelle cellule che esprimono il recettore Fc delle IGg, scatenando poi la sindrome da tempesta citochinica, se e quando il vaccinato viene in contatto naturalmente con il virus. A tale proposito specifichiamo che il virus della MERS non utilizza i recettori ACE2, ma i DPP4 (dipeptidil-peptidasi IV).
Per controllare la FIP gli unici farmaci che si sono rivelati efficaci sono gli inibitori delle proteasi e gli analoghi dei nucleosidi, in quanto capaci di bloccare il clivaggio della poliproteina e di interrompere la trascrizione dell’RNA virale. La malattia regredisce, ma non scompare se non in alcuni casi sporadici.
Esclusivamente su base teorica, ma supportando la nostra impressione con le molteplici similitudini tra la peritonite infettiva dei gatti e la patogenesi del COVID-19, ipotizziamo la possibilità che anche per il SARS-COV2 possa sussistere questo meccanismo da biotipi a virulenza differente, immaginando che asintomatici e paucisintomatici siano interessati da stipiti a bassa virulenza, e che nel 5-10% dei soggetti avvenga uno switch che determini il passaggio a biotipi a virulenza esaltata. Come già specificato nei gatti lo switch avviene dopo mesi di infezione enterica, ma questo non esclude che nella specie umana si possa ipotizzare una transizione più celere; del resto nell’uomo non si conoscono ancora definitamente i tempi di escrezione virale e molte delle “reinfezioni” osservate ad oggi potrebbero essere riconducibili ad una eliminazione intermittente del virus, come già osservato in molte altre specie. Questo potrebbe spiegare perché alcuni paucisintomatici, probabilmente infettatisi con una bassa carica virale, si aggravano all’improvviso, senza apparente motivo, sviluppando infezioni gravissime che spesso esitano nella morte. Pensiamo a persone giovani e in salute, nella quali si scatena la tempesta citochinica che, in concomitanza con i gravi disturbi della coagulazione sanguigna (anche nei gatti affetti da FIP si ha un notevole innalzamento ematico del dimero-D), e della polmonite interstiziale, sviluppano quadri sintomatologici severi ed epidemiologicamente incontrollabili. Anche per le infezioni acute da SARS-COV2 i farmaci che si sono rivelati efficaci sono gli inibitori delle proteasi e gli inibitori della RdRp, e per quanto sia ormai accettata la funzione di altri principi attivi rivolti ad arginare alcune delle conseguenze sintomatiche dell’infezione, nei gatti affetti da biotipi FIPV gli antivirali sono gli unici in grado di permettere una regressione della patologia che, occorre ribadire, è gravissima e pressoché incontrollabile dal punto di vista epidemiologico.
Bibliografia consultata
Shi, J., Wen, Z., Zhong, G., Yang, H., Wang, C., Huang, B., … & Zhao, Y. (2020). Susceptibility of ferrets, cats, dogs, and other domesticated animals to SARS–coronavirus 2. Science.
Decaro, N., Martella, V., Saif, L., & Buonavoglia C. (2020). COVID-19 from veterinary medicine and one health perspectives: What animal coronaviruses have taught us. Research in Veterinary Science.
Lin, L., Lu, L., Cao, W., & Li, T. (2020). Hypothesis for potential pathogenesis of SARS-CoV-2 infection——a review of immune changes in patients with viral pneumonia. Emerging Microbes & Infections, 9(1), 727-732.
Jaimes, J. A., Millet, J. K., Stout, A. E., André, N. M., & Whittaker, G. R. (2020). A Tale of Two Viruses: The Distinct Spike Glycoproteins of Feline Coronaviruses. Viruses, 12(1), 83.
Tilocca, B., Soggiu, A., Musella, V., Britti, D., Sanguinetti, M., Urbani, A., & Roncada, P. (2020). Molecular basis of COVID-19 relationships in different species: a one health perspective. Microbes and Infection.
Guarner, J. (2020). Three emerging coronaviruses in two decades: the story of SARS, MERS, and now COVID-19. American Journal of Clinical Pathology, 153, 420-421.
Luan, J., Lu, Y., Jin, X., & Zhang, L. (2020). Spike protein recognition of mammalian ACE2 predicts the host range and an optimized ACE2 for SARS-CoV-2 infection. Biochemical and Biophysical Research Communications.
Li, R., Qiao, S., & Zhang, G. (2020). Analysis of angiotensin-converting enzyme 2 (ACE2) from different species sheds some light on cross-species receptor usage of a novel coronavirus 2019-nCoV. Journal of Infection, 80(4), 469-496.