L’uso dell’IA nella tossicologia predittiva sta trasformando lo sviluppo dei farmaci e contribuendo alla riduzione degli animali impiegati nella ricerca. Il progetto CUPID, che ha vinto il Premio IPAM-Farmindustria 2025, mostra come modelli di machine learning possano anticipare la cardiotossicità delle molecole e guidare scelte più sicure, rapide e sostenibili nella ricerca farmacologica
L’intelligenza artificiale (IA) ha un ruolo sempre più rilevante in molte aree della ricerca scientifica, non ultima la tossicologia. Ne abbiamo parlato più volte, perché l’uso dell’IA ha un effetto diretto non solo sui risultati della ricerca, anche in termini di rapidità, ma anche sul benessere animale. Queste tecnologie, infatti, trovano una diretta correlazione con il principio delle 3R, perché possono contribuire in modo significativo alla riduzione degli animali usati e consentono di arrivare alla sperimentazione animale, in vivo, in modo più mirato.
In effetti, è proprio a una piattaforma basata sull’IA – e più precisamente sulla tecnologia del machine learning, che ha vinto il Premio IPAM-Farmindustria di quest’anno, assegnato a giovani ricercatrici e ricercatori «che risultino autori principali di un lavoro scientifico rilevante nel settore dei metodi alternativi (intesi come filosofia delle 3R) nella ricerca e sviluppo di prodotti farmacologici». Ci siamo fatti raccontare il lavoro da Nicola Gambacorta, post-doc al Prometheus Lab dell’Università di Bari, cui è stato assegnato il premio.
Il problema della cardiotossicità dei nuovi farmaci
«Uno dei principali problemi di sicurezza dei nuovi farmaci è la cardiotossicità: a volte, anche per quelli già approvati (soprattutto nel caso dei chemioterapici, ma non solo), si registrano effetti collaterali sul cuore, tra cui soprattutto aritmie. La conseguenza è il ritiro dal mercato», spiega Gambacorta.
Abbiamo spiegato in passato il processo che porta dallo sviluppo all’approvazione e all’immissione in commercio di un farmaco: si tratta di un percorso lungo, nel quale il nuovo farmaco è studiato nel dettaglio e poi via via testato in organismi viventi, essere umani compresi, per capirne con la maggior precisione possibile efficacia e sicurezza. Il monitoraggio post-marketing è parte integrante di questo percorso, ma è chiaro che l’ideale sarebbe avere farmaci ancora più sicuri, che non richiedano alcun ritiro. «Le ragioni per cui sia proprio la cardiotossicità uno dei problemi più comuni dei nuovi farmaci non sono chiare. Si sospetta che la cardiotossicità di alcune molecole antitumorali possa essere legata alla loro particolare struttura chimica: molte di esse possiedono anelli aromatici o regioni lipofile che mostrano una certa affinità per i canali ionici cardiaci, provocando aritmie», continua il ricercatore.
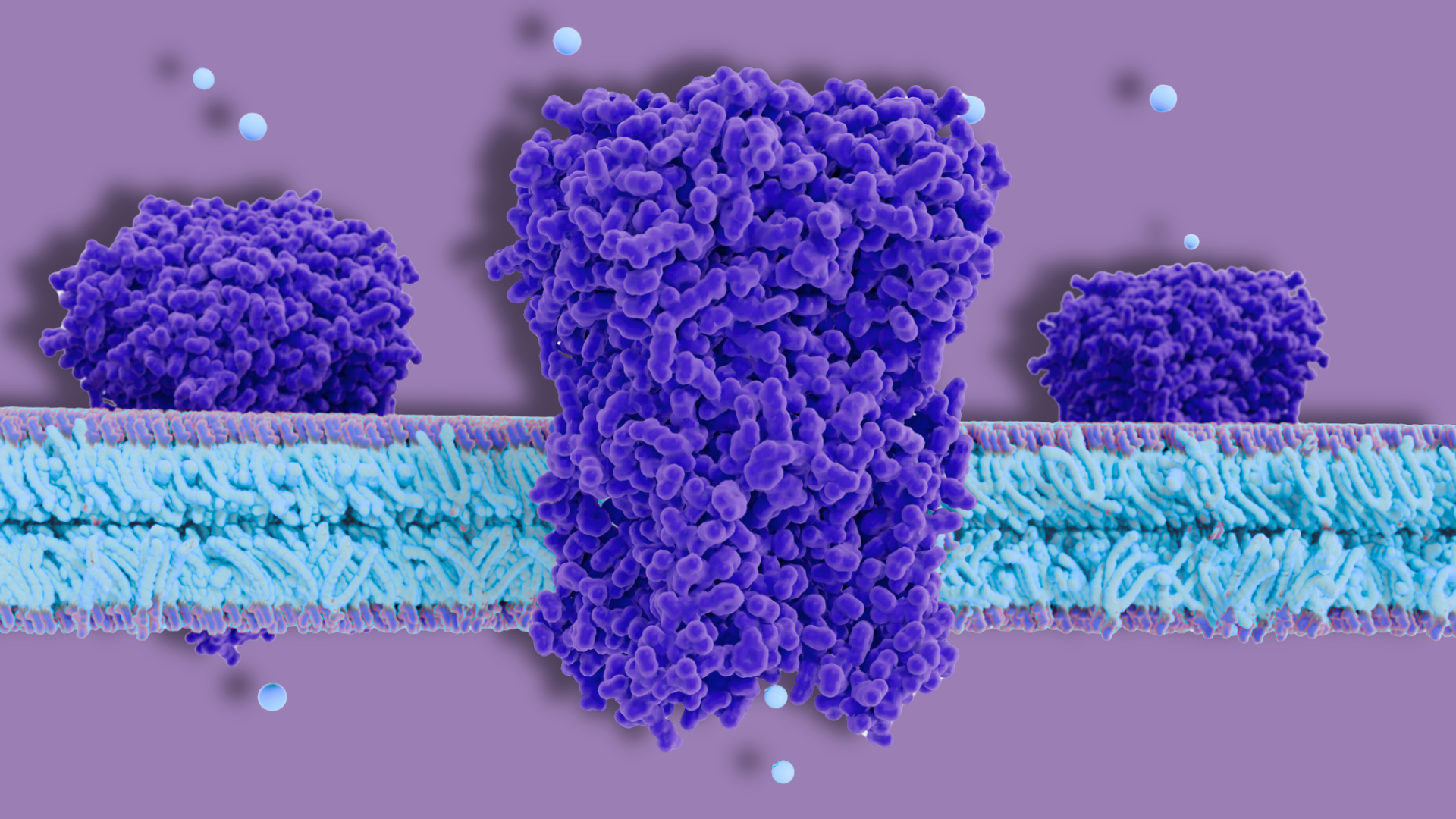
Sono proprio i canali ionici al centro del progetto vincitore del Premio IPAM-Farmindustria. Si tratta di strutture presenti sulla membrana delle cellule che si aprono e si chiudono per permettere il passaggio di particelle cariche, come sodio, potassio o calcio. Questi movimenti sono fondamentali per la funzionalità cellulare e, nel cuore, permettono anche di generare e controllare il battito cardiaco.
IA per la tossicologia: la piattaforma CUPID
«Il problema della cardiotossicità dei farmaci è noto da tempo e, proprio per questa ragione, molto studiato. La maggior parte delle ricerche, però, si basa su uno specifico canale per il potassio, detto ERG, conosciuto per la sua interazione con i farmaci», spiega Gambacorta. «Tuttavia, gli stessi enti regolatori riconoscono che anche altri due canali specifici del muscolo cardiaco, uno al sodio e uno al calcio, contribuiscono in modo significativo alle aritmie da farmaco. Quindi nel nostro lavoro abbiamo tenuto in considerazione anche questi ultimi».
Il gruppo di ricerca è partito da dati sperimentali per costruire, attraverso tecniche di machine learning, dei modelli in silico per questi tre canali ionici del cuore. In pratica, confrontando diversi algoritmi e scegliendo, per ogni canale, quello che garantiva le performance migliori, Gambacorta e colleghi hanno costruito per ciascun canale un modello in grado di rispondere alla domanda: questa molecola può inibire il canale e dunque contribuire alla cardiotossicità? «La fase più lunga e importante del lavoro è stata la raccolta e pulizia dei dati, perché è la qualità di questi ultimi a determinare la qualità dei risultati modellistici», racconta il ricercatore.
Inoltre, i modelli sono stati validati in modo rigoroso. Non meno importante, hanno aggiunto quello noto come dominio di applicabilità, ossia lo spazio chimico per cui un modello di IA può fare previsioni affidabili. In altre parole, hanno fatto in modo che il modello indichi quanto la sua previsione è attendibile. Infine, hanno aggiunto la componente di explainability, cioè hanno fatto in modo che il modello essenzialmente spieghi come è arrivato alla sua conclusione: il risultato è una mappa colorata e intuitiva nella quale il modello evidenzia quali componenti di una molecola aumentano il rischio di cardiotossicità e quali sono invece associati a una maggior sicurezza. Al contempo, poiché questo rende possibile anche capire come modificare la struttura chimica della molecola per renderla più sicura, permette una progettazione razionale dei farmaci.
«Il risultato di questo lavoro è la piattaforma web CUPID, del tutto gratuita, perché crediamo nell’accessibilità della ricerca – peraltro pensata come il più possibile accessibile anche per i non esperti, dal punto di vista sia dell’output sia dell’interfaccia grafica», spiega Gambacorta. «CUPID è una piattaforma predittiva per lo studio della cardiotossicità, ma anche un esempio concreto di come l’IA possa aiutarci ad aumentare la sicurezza farmacologica e accelerare la ricerca e, insieme, contribuire al principio delle 3R e alla riduzione degli animali impiegati nei test».