Ci facciamo raccontare da Andrea Bezze, vincitore del premio IPAM-Farmindustria 2023, la sua ricerca per lo sviluppo di un modello in vitro del glioblastoma, un tumore cerebrale molto aggressivo per il quale non è oggi disponibile un trattamento efficace. Ricreando la complessità del microambiente tumorale che ostacola la somministrazione dei farmaci, i ricercatori vogliono ora mettere a punto un modello che consenta di riprodurre nel modo più fedele possibile la situazione reale, così da ottimizzare le strategie terapeutiche
Abbiamo di recente scritto del premio IPAM-Farmindustria 2023, assegnato per lavori che, in accordo con il principio delle 3R, contribuiscano allo sviluppo o al perfezionamento di metodi alternativi. La ricerca premiata quest’anno era dedicata allo sviluppo di un modello in vitro che consentisse lo studio di metodi per il trasporto dei farmaci contro il glioblastoma, un tumore cerebrale altamente aggressivo e per il quale manca, a oggi, una cura efficace.
Lo studio è il frutto del lavoro di tesi di laurea magistrale di Andrea Bezze, oggi dottorando al Politecnico di Torino, dove porta avanti la ricerca premiata: abbiamo voluto farcela raccontare.
Un microambiente complesso
Il glioblastoma è una forma di tumore che origina da cellule della glia, cioè quelle che svolgono funzioni di sostegno per i neuroni. Si tratta di un tumore molto aggressivo, per il quale le possibilità di trattamento sono oggi ancora limitate: di norma, prevedono la rimozione chirurgica quando possibile, seguita da radio e chemioterapia. Tuttavia, purtroppo il glioblastoma è altamente invasivo, e spesso rimangono cellule infiltranti che determinano la ricomparsa del tumore.
«La maggior parte dei trattamenti per il glioblastoma risultano fallimentari perché non riescono a rispondere alla complessità dell’ambiente tumorale, caratterizzata da vari elementi tra cui, per esempio, la presenza di cellule staminali tumorali (responsabili dei meccanismi di resistenza ai trattamenti chemioterapici), una matrice extracellulare molto rigida e la barriera ematoencefalica che ostacola l’accumulo di farmaci», spiega Bezze. «A oggi, inoltre, non abbiamo un modello preclinico diverso dall’animale che possa replicare in modo efficace questa complessità ambientale. Per questa ragione, spesso i trattamenti superano la fase di studio in vitro ma falliscono poi nell’animale, con quanto consegue in termini di problemi etici, di traslazione al paziente ed economici. Inoltre, la malattia umana presenta importanti differenze rispetto a quella dei modelli di altre specie, ed è quindi particolarmente importante cercare di trovare modelli che ci permettano di replicare il glioblastoma nel modo più simile possibile alla situazione che si presenta nei pazienti».
Il lavoro di Bezze, che ha visto come relatori i professori Gianluca Ciardelli e Clara Mattu del Politecnico di Torino, aveva proprio lo scopo d’iniziare a rispondere a questa mancanza: l’obiettivo, infatti, era sviluppare un modello in grado di replicare la complessità del microambiente tumorale. Per farlo, il gruppo di ricerca ha scelto di usare esclusivamente cellule di origine umana, che rispondevano al duplice scopo di essere più somiglianti alla situazione reale che si presenta nel paziente e di limitare il ricorso a componenti animali, in ottica 3R.
Sferoidi per riprodurre il gliobastoma
«Abbiamo usato diverse popolazioni di cellule tumorali, differenziate e staminali, e abbiamo incluso anche cellule derivanti dal microambiente circostante come cellule della microglia (che nel cervello svolgono funziona immunitaria e, alterate nel glioblastoma, contribuiscono alla progressione del tumore) ed endoteliali per la realizzazione dei capillari», spiega Bezze.
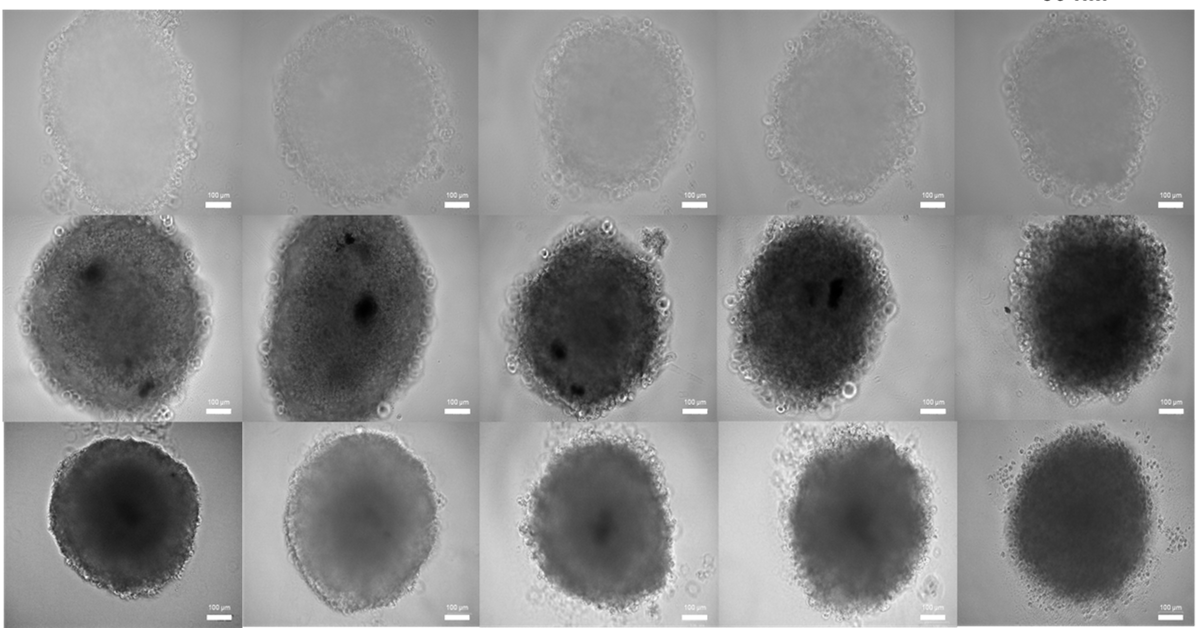
Il modello tumorale è stato realizzato con i cosiddetti sferoidi multicellulari, ossia culture tridimensionali formate da diversi tipi di cellule che formano aggregati compatti e in grado di replicare alcune caratteristiche del tumore. Per esempio, nel caso del glioblastoma, gli sferoidi permettono di simulare la massa tumorale presentando un interno necrotico e, soprattutto, la formazione di diverse nicchie di cellule staminali tumorali localizzate in forma di aggregati in diverse regioni del tumore. Inoltre, sempre per rendere il modello quanto più somigliante alla situazione reale, il gruppo di ricerca ha incapsulato gli sferoidi in un modello di matrice extracellulare, con componenti basati su collagene e polisaccaridi, che replica composizione e proprietà meccaniche del glioblastoma. «In parallelo, abbiamo sviluppato un sistema di rete vascolare dei capillari cerebrali usando sia cellule endoteliali umane sia una piattaforma microfluidica in grado di ospitare il modello di tumore e anche d’indurne la vascolarizzazione», aggiunge Bezze.
Oltre a mettere a punto i diversi modelli (il solo sferoide, lo sferoide con la matrice e quello contenente anche il sistema di vascolarizzazione), il gruppo di ricerca ha iniziato lo studio preliminare per testare il rilascio dei farmaci chemioterapici. «Abbiamo testato l’uso di nanoparticelle che agissero come vettori per il farmaco – nello specifico, il bortezomib, un farmaco oggi usato nel trattamento di forme tumorali diverse dal glioblastoma ma che, dai dati della letteratura, potrebbe essere efficace anche per quest’ultimo», spiega Bezze.
Ottimizzare la somministrazione del trattamento
«I test condotti finora hanno dimostrato che, effettivamente, aumentare la complessità del modello influenza in modo significativo la risposta al trattamento. Questo ci ha permesso anche di evidenziare alcuni limiti del trasporto mediato da nanoparticelle: per esempio, le cellule della glia possono accumularne di più rispetto alle cellule tumorali, e ridurre quindi l’effetto desiderato. E, nel modello vascolarizzato, abbiamo potuto replicare l’effetto di barriera che si presenta nei capillari cerebrali verificando che, come osservato negli studi in vivo su modelli murini, c’è un ostacolo all’accumulo delle particelle che rimangono confinate nei vasi e non arrivano alla massa tumorale», continua Bezze. «Per questo, in parallelo ai test con le nanoparticelle, abbiamo iniziato anche a condurre dei test nei quali le nanoparticelle con il farmaco erano trasportate da cellule della glia, in grado di penetrare nei vasi e raggiungere il tumore. Questa strategia potrebbe essere un giorno traslata anche in vivo, permettendo un accumulo mirato del farmaco nella sede tumorale, così da ridurne gli effetti collaterali».
In altre parole, il modello sviluppato è sufficientemente verosimile da riprodurre anche i limiti che si verificano nel trattamento del glioblastoma umano, aspetto fondamentale per ottimizzarne le strategie di trattamento.
La ricerca prosegue nel percorso di dottorato di Bezze, nel quale il modello sarà ulteriormente raffinato con l’introduzione di ulteriori tipi cellulari (per esempio periciti e astrociti, componenti chiave della barriera ematoencefalica che limitano ulteriormente l’accumulo di farmaci) e per migliorare la composizione del gel che simula la matrice extracellulare. «In particolare, vogliamo rimuovere alcuni elementi ancora animali (come il collagene), cercando di arrivare a materiali sintetici o umani che abbiano caratteristiche fisiche e chimiche più somiglianti a quelle del glioblastoma», conclude Bezze. «Inoltre, stiamo cercando di modulare queste caratteristiche in modo da replicare le diverse fasi della progressione tumorale, con matrice più morbide e cellule meno infiltranti per le prime fasi e cellule a maggiore infiltrazione e matrice più rigida per gli stadi più avanzati».
Nell’immagine di copertina: la fotografia al microscopio degli sferoidi multicellulari. Crediti: Andrea Bezze, Three-dimensional model to predict cell‐mediated nanoparticles drug delivery for Glioblastoma treatment