La ricerca sugli xenotrapianti d’organo procede rapidamente, e negli ultimi due anni sono stati eseguiti i primi interventi su pazienti vivi con due trapianti di cuore e due di rene, tutti approvati dall’ente regolatorio statunitense in mancanza di alternative. È importante cercare di fare il quadro di un campo di studi in rapido avanzamento, nel quale sempre più si rivelano limiti e potenzialità
Nel mondo, non solo la ricerca ma anche gli interventi di xenotrapianto (ossia il trapianto di organi di specie diverse dalla nostra) sta proseguendo in modo molto attivo. Come abbiamo avuto modo di ricordare in diverse occasioni, questo campo di studi potrebbe risolvere, un giorno, un problema enorme per la sanità: la mancanza di organi sufficienti a rispondere alle necessità delle migliaia di persone in attesa di trapianto d’organo, e che ne hanno bisogno per sopravvivere.
Dal punto di vista della ricerca, gli aspetti da indagare sono svariati – così come le potenzialità di questo approccio ma anche, inevitabilmente, i problemi che si stanno evidenziando man mano che iniziano a essere eseguiti gli interventi, anche su pazienti vivi. È bene specificare da subito che, nel caso dei pazienti vivi, gli xenotrapianti sono stati condotti negli Stati Uniti secondo specifici protocolli dell’FDA, l’ente regolatorio statunitense, che prevede l’accesso a trattamenti sperimentali per persone a rischio di vita e per le quali non vi sono altri trattamenti possibili.
Data l’importanza di questo ambito di ricerca, vale la pena iniziare a fare un punto sui risultati raggiunti finora, così come sulle criticità emerse. Ci concentriamo sugli xenotrapianti di rene e cuore, al momento i più avanzati, eseguiti su pazienti vivi negli ultimi anni.
I primi xenotrapianti di rene su pazienti vivi
Tra gli interventi di xenotrapianto più recenti vi è quello di rene eseguito al Massachusetts General Hospital (MGH) a marzo di quest’anno, il primo – per quanto riguarda quest’organo – su un paziente vivo, Rick Slayman. I precedenti, infatti, erano stati eseguiti su persone dichiarate cerebralmente morte. Come avevamo raccontato, l’intervento ha segnato una pietra miliare per questo tipo di trapianti e ha acceso molte speranze nel mondo biomedico. È di poco tempo fa la notizia che Slayman è deceduto. In un comunicato, il MGH spiega che non vi sono indicazioni che suggeriscano che la morte sia un risultato dello xenotrapianto, ed esprime il proprio cordoglio e le condoglianze alla famiglia. In una dichiarazione, quest’ultima ricorda come Slayman avesse detto che «Una delle ragione per le quali si era sottoposto alla procedura fosse dare speranza alle migliaia di persone che avevano bisogno di un trapianto per sopravvivere». E, continua la dichiarazione, «La sua eredità sarà quella d’ispirare i pazienti, i ricercatori, e i professionisti sanitari ovunque».
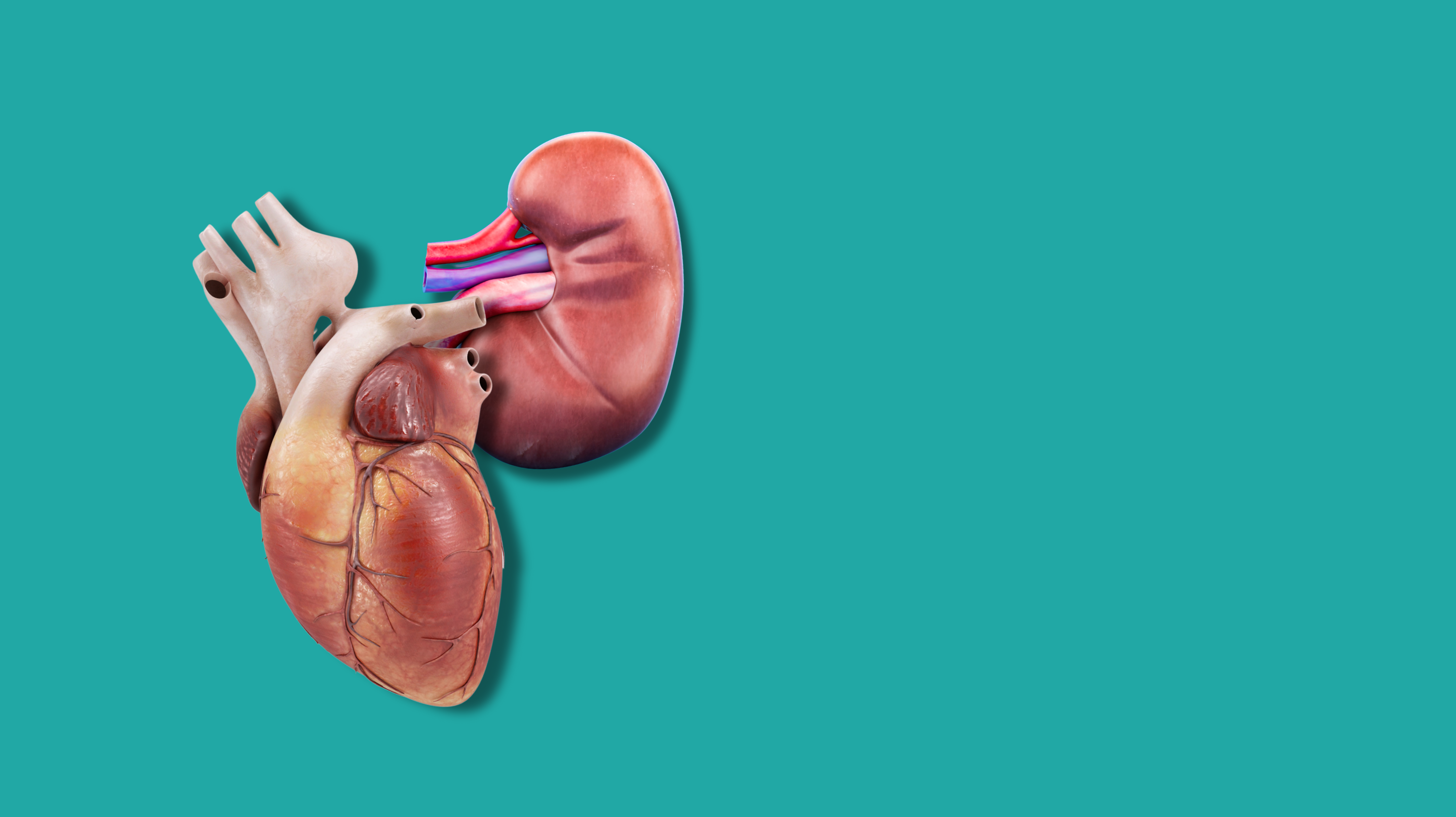
Poco dopo l’intervento al MGH, ad aprile di quest’anno, una donna con insufficienza sia cardiaca sia renale ha ricevuto, in un primo passaggio, un dispositivo di assistenza ventricolare (una pompa meccanica per il cuore); a qualche giorno di distanza, le è stato trapiantato un rene. Quest’ultimo, come nel caso degli altri interventi eseguiti, era di origine suina e geneticamente modificato per limitare il rischio di rigetto e di possibili infezioni, ma in questo caso vi è stato un passaggio in più: sotto il rene è stato infatti posto anche un tessuto derivato dal timo, l’organo nel quale avviene la maturazione di linfociti T. Anch’esso di origine suina e geneticamente modificato, serve a condizionare il sistema immunitario del ricevente per aiutarlo a riconoscere l’organo come proprio, limitando il rischio di rigetto. È la prima volta che questo “xenotimorene” (il nome commerciale è UThymoKideny) viene trapiantato in una persona viva, così come è la prima volta che viene eseguito il doppio intervento d’inserimento della pompa cardiaca e dello xenotrapianto renale.
Una differenza importante tra i due interventi è nelle modifiche genetiche introdotte negli organi trapiantati. Mentre nel primo caso erano state inserite 69 modifiche nel genoma del maiale donatore, nel secondo intervento, condotto alla New York University Langon Health, la modifica genetica era soltanto una. «Utilizzando maiali con una singola modifica genetica, possiamo comprendere meglio il ruolo che un cambiamento stabile nel genoma può avere nel rendere lo xenotrapianto un’alternativa praticabile. Poiché questi maiali possono riprodursi e non richiedono clonazione come le strategie di gene editing più complesse, questa rappresenta una soluzione sostenibile alla carenza di organi per la donazione. Se vogliamo iniziare a salvare delle vite più rapidamente, limitare le modifiche genomiche e l’uso di farmaci è la soluzione», ha affermato Robert Montgomery, Direttore del Dipartimento di Chirurgia che ha guidato l’intervento.
Più precisamente, la singola modifica genetica del rene trapiantato ad aprile riguarda la rimozione di un gene che codifica per una molecola, l’alpha-gal. Si tratta di un carboidrato comune nelle cellule dei mammiferi, e più precisamente duna piccola porzione in grado essere riconosciuto da specifici anticorpi (epitopo), stimolando la risposta del sistema immunitario. Nel caso degli xenotrapianti, la presenza di questa molecola può essere responsabile del rigetto acuto dell’organo.
Gli xenotrapianti di cuore su pazienti vivi
Gli xenotrapianti di rene sono stati forse i più seguiti a livello mediatico, anche a causa della difficoltà di questo tipo di intervento. Il rene, in effetti, presenta alcuni aspetti di complessità che rendono questo tipo di trapianto particolarmente difficile: si tratta di organi molto vascolarizzati, la cui funzione di eliminazione delle tossine, bilanciamento degli elettroliti e regolazione della pressione ha ripercussioni sull’omeostasi dell’intero organismo.
Nonostante la maggior attenzione ricevuta, gli xenotrapianti di rene non sono stati gli unici eseguiti su pazienti vivi. Già nel gennaio 2022, infatti, è stato eseguito uno xenotrapianto di cuore, il primo dopo il primo pionieristico tentativo della metà degli anni Ottanta, nel quale era stato trapiantato un cuore di babbuino in una neonata con sindrome del cuore sinistro ipoplastico, deceduta dopo una ventina di giorni dall’intervento a causa del rigetto dell’organo.
Rispetto agli anni Ottanta, l’ingegneria genetica ha compiuto molti passi avanti, così come le nostre conoscenze nell’ambito degli xenotrapianti – che hanno portato, per esempio, a riconoscere i maiali come i migliori candidati come specie donatrice, perché hanno organi con dimensioni e struttura più simili alle nostre.
L’intervento del 2022, condotto dalla School of Medicine dello University of Maryland Medical Centre, è stato descritto sul Lancet. Il paziente è morto 60 giorni dopo lo xenotrapianto: per i primi 47, il cuore suino si è dimostrato funzionare, ma poi, scrivono i ricercatori, «È diventato rapidamente edematoso e ha perso la funzione diastolica» (la diastole è il passaggio di sangue dagli atri ai ventricoli del cuore). Le condizioni del paziente sono andate velocemente peggiorando, fino alla morte. Secondo i ricercatori, tre sono le cause possibili: una reazione immunitaria che ha causato il rigetto dell’organo (pur avendo evitato il rigetto acuto); la somministrazione di anticorpi, a seguito dell’intervento, che potrebbe aver attivato il sistema immunitario; oppure la riattivazione di virus suini. Per quanto riguarda quest’ultima possibilità, è da segnalare che il cuore suino era stato ovviamente analizzato prima dell’intervento, e non aveva mostrato la presenza di virus. Le indagini postmortem hanno però mostrato la presenza di citomegalovirus e roseolovirus suini, suggerendo l’importanza di test più sensibili per verificare l’eventuale infezione nell’organo.
Il secondo xenotrapianto di cuore su un paziente vivo è stato eseguito nel settembre 2023, sempre dallo staff della University of Maryland School of Medicine e, come per gli altri casi, sempre con approvazione dell’FDA per la mancanza di altre opzioni terapeutiche. Come il cuore suino usato nell’intervento precedente, anche questo aveva dieci modifiche genetiche: alcuni geni erano stati eliminati e altri aggiunti per ridurre il rischio di reazione immunitaria, mentre un singolo gene è stato “spento” per prevenire una crescita eccessiva del tessuto cardiaco suino. Il paziente è morto sei settimane dopo l’intervento, alla fine di ottobre. I medici non hanno ancora rilasciato informazioni sulle possibili cause della morte, ma «Come per il primo paziente, intendiamo condurre un’analisi dettagliata per individuare i fattori che possono essere evitati nei prossimi trapianti; questo ci permetterà di continuare ad avanzare ed educare i colleghi del campo sulla base delle nostre esperienze», ha affermato in un comunicato Muhammad Mohiuddin, uno dei medici che hanno condotto i due interventi.
Prospettive future
A fronte degli interventi eseguiti fino a oggi e dei loro esiti, cosa si può dire degli xenotrapianti? Si stanno rivelando una strada chiusa o possiamo invece continuare a considerarli una speranza per il futuro?
Su Nature, Robert Montgomery ha ammesso che gli xenotrapianti «Non hanno avuto il successo suggerito dagli studi sui primati». In effetti, la ricerca sui nostri parenti più stretti aveva dato alcuni risultati molto incoraggianti: in una ricerca del 2023, per esempio, erano stati eseguiti degli xenotrapianti di rene suino, con differenti modifiche genetiche, su 20 macachi cinomologi. Di questi, a 15 sono stati trapiantati reni nei quali erano stati inseriti anche geni umani: 9 macachi sono sopravvissuti più di 50 giorni; cinque per più di un anno e uno è sopravvissuto più di due anni.
La minor sopravvivenza, a oggi, dei pazienti umani non è però vista come un segno del fallimento degli xenotrapianti. Innanzitutto, gli organi si sono dimostrati funzionanti sia sulle persone dichiarate cerebralmente morte sia sui pazienti vivi. Non si può nemmeno dimenticare che tutte le persone sottoposte allo xenotrapianto finora erano in condizioni molto gravi, e quindi particolarmente fragili. In effetti, alcuni medici ritengono sia importante iniziare dei trial clinici che consentano di raccogliere in modo più sistematico informazioni sulla procedura.
Comunque, questi primi tentativi ci stanno insegnando molto sugli aspetti da tenere in considerazione, dai test cui è necessario sottoporre gli organi prima del trapianto al tipo di trattamento necessario per i pazienti, per esempio in termini di regime di immunosoppressori.
Insomma, lo xenotrapianto non è affatto visto come una strada chiusa, bensì come una procedura ancora promettente e che, sempre più, richiede di essere indagata per poterla eseguire in modo ottimale. Anche perché, come dicevamo all’inizio di questo articolo, rappresenta la possibile risposta a un problema che oggi non ha nessun’altra soluzione: la grave carenza d’organi a fronte della grande domanda di chi è in attesa di trapianto per sopravvivere.
Concludiamo ricordando che, in Italia, l’uso di animali per questo tipo di studi è vietato. L’applicazione del divieto è prorogata al luglio 2025 ma, una volta reso effettivo, chiuderebbe la strada alla ricerca in questo campo (e lo stesso dicasi per gli studi sulle sostanze d’abuso). «Vedere l’impegno e gli avanzamenti dei vari centri di ricerca nel mondo dovrebbe davvero farci riflettere. Rischiamo di trovarci, un domani, a dover acquisire i risultati di queste ricerche dall’estero – risultati che derivano comunque dall’uso di animali», commenta Giuliano Grignaschi, portavoce di Research4Life. «Soprattutto, dovremmo chiederci se davvero il divieto di usare animali per questi campi di studio è una scelta eticamente coerente. Oppure se, invece, non rischia di lasciare indietro delle persone, pazienti che hanno bisogno di nuovi organi per sopravvivere, per ragioni puramente politiche. La ricerca nel campo degli xenotrapianti e delle sostanze d’abuso non è diversa da quella in altri campi biomedici che si basano sull’uso di animali, e la ricerca dovrebbe garantire la stessa dignità a tutte le persone malate, non certo privilegiarne alcune senza motivi concreti».


Da profano, ammiro i lenti, ma costanti, progressi della ricerca, così come ammiro i pazienti in vita che si sono volontariamente sottoposti ad interventi di xenotrapianto. Spiace per la posizione italiana su un tema così cruciale
Nel novecento, il Prof W Osler autore del primo manuale di Medicina Interna e co fondatore dello Johns Hopkins Hospital di Baltimora defini’ la medicina Science of uncertainty ,an art of probability. Non è difficile intuire perchè la medicina non possa sopravvivere alla evoluzione della specie umana e delle sue malattie senza una continua virtuosa sperimentazione che ne permetta l’ adattamento. Se è vero che la produzione di organi umanizzati in animali geneticamente modificati potrebbe riuscire a sopperire alla carenza di organi umani donati, altrettanta speranza va riposta negli sviluppi della medicina rigenerativa il cui obbiettivo finale è la produzione di organi completi a partire da cellule staminali umane.